上海虹桥中学初三(上)期中化学试题
1、选择题(共15小题,每小题2分,满分30分)
1.(2分)9月26日,国家主席习近平到黑龙江齐齐哈尔考察。期间习主在中车齐车集团公司铁路货车试验研究中心考察。观看了对C80型铝合金煤炭运输专用车所进行的疲劳与振动试验。下列有关说法不正确的是()

A.煤炭专用运输车的轨道材料是不锈钢制成的,不锈钢是金属材料
B.煤炭专用运输车车体材料为铝合金,表面刷漆是为了防锈、美观
C.为了增强煤炭运输专用车的抗疲劳性,车体连接处可以使用韧性好、硬度大的生铁
D.煤炭燃烧过程中的能量转化是化学能转化成内能
2.(2分)下列过程中发生化学变化的是()
A. 铁钉生锈条件探究 B.
铁钉生锈条件探究 B. 氢氧化钠溶液导电
氢氧化钠溶液导电
C. 探究分子运动 D.
探究分子运动 D. 燃烧条件探究
燃烧条件探究
3.(2分)下列实验基本操作正确的是()
A.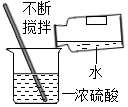 稀释浓硫酸
稀释浓硫酸
B.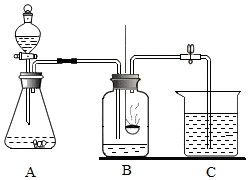 向NaOH溶液中滴加稀盐酸
向NaOH溶液中滴加稀盐酸
C. 测溶液酸碱性
测溶液酸碱性
D.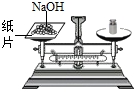 称量氢氧化钠
称量氢氧化钠
4.(2分)下列有关粒子结构示意图的说法,正确的是()
A.①和②的化学性质相似
B.③④⑥对应的元素坐落于周期表的同一周期
C.①③④具备相对稳定结构
D.③和⑤可以形成A2B型化合物
5.(2分)下列物质的作用正确的是(()
A. 生石灰改良酸性土壤
生石灰改良酸性土壤
B.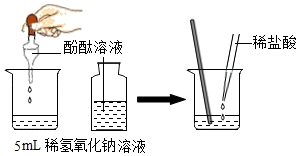 盐酸做铅蓄电池
盐酸做铅蓄电池
C.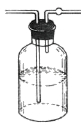 稀硫酸干燥氢气
稀硫酸干燥氢气
D.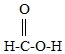 农业上用氯化钠溶液选种
农业上用氯化钠溶液选种
6.(2分)下列实验现象描述错误的是()
A.氢氧化钠固体放置于空气中:表面潮湿并渐渐溶解
B.向稀盐酸中滴加紫色石蕊溶液:溶液由无色变为红色
C.铁钉放入足量的稀盐酸中:银白色固体表面产生气泡,银白色固体降低不消失
D.向氢氧化镁中滴加无色酚酞溶液:溶液由无色变为红色
7.(2分)下列应用、化学方程式和基木反应种类对应正确的是()
A.工业用一氧化碳还原氧化铁 Fe2O3+3CO![]() 2Fe+3CO2 还原反应
2Fe+3CO2 还原反应
B.用pH试纸测得正常雨水的pH约为5.6 H2O+CO2=H2CO3 化合反应
C.用氢氧化镁治疗胃酸过多 Mg(OH)2+2HCl═MgC12+2H2O 中和反应
D.不可以用铁桶盛装波尔多液 Fe+CuSO4═Cu+FeSO4 置换反应
8.(2分)下列说法正确的是()
A.为预防自行车链条生锈,可以在自行车链条上喷漆
B.将牵牛花等有色花瓣在研钵中捣烂,加入无水乙醇浸泡,浸出液即酸碱指示剂
C.若氢氧化钠不慎沾到皮肤上,可用很多水冲洗后涂3%~5%的碳酸氢钠溶液
D.人体血浆的pH在7.35~7.45之间
9.(2分)人被蚊虫叮咬后叮咬处会红肿痛痒,是由于蚊虫在人的皮肤内分泌出蚁酸,蚁酸的结构如图所示,下列关于蚁酸的叙述正确的是()
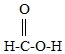
A.蚁酸中碳、氢、氧原子的水平比为6:
1:
16
B.蚁酸分子中氧元素水平分数最大
C.蚁酸是由多原子构成的化合物
D.蚁酸显酸性,遇见紫色石蕊溶液会变成红色
10.(2分)下列有关资源能源的说法,正确的是()
A.硫酸是要紧的化工商品,可用于生产化肥、农药等
B.大家正在借助和开发的其他能源有太阳能、风能、地热能、水能等
C.将煤隔绝空气加大热,可得到焦炭、煤油、煤气等很多有用的物质
D.地球上的咸水约占全球水储量的97.47%
11.(2分)下列有关事实用微粒的看法讲解正确的是()
选项 | 事 实 | 解 释 |
A | 食盐在冷水中溶解得更慢 | 氯化钠分子运动速率随温度减少而减慢 |
B | 夏季氦气球在阳光下曝晒过久易爆炸 | 氦原子间的间隔随温度的升高而增大 |
C | 一氧化碳有可燃性而二氧化碳不可燃 | 构成分子的原子的类型不同 |
D | 氢氧化钾溶液能使紫色石蕊溶液变蓝 | 在水中会解离出钾离子和氢氧根离子 |
A.A B.B C.C D.D
12.(2分)区别下列各组物质的两种办法都正确的是()
| 需区别物质 | 办法一 | 办法二 |
A | 氯化钠和氢氧化钠 | 加水溶解,触摸烧杯壁 | 品尝 |
B | 硝酸铵与碳酸氢铵 | 闻气味 | 加入稀盐酸 |
C | 聚乙烯塑料和尿醛塑料 | 加热 | 察看颜色 |
D | 铜和铁 | 加入稀盐酸 | 加入硝酸银溶液 |
A.A B.B C.C D.D
13.(2分)如图是甲、乙、丙三种不同物质(不含结晶水)的溶解度曲线。下列叙述正确的是()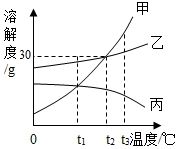
A.t1℃时,甲、乙、丙三种物质溶液溶质的水平分数大小关系是乙>甲=丙
B.将100g甲的饱和溶液和100g乙的饱和溶液混合可以得到200g甲、乙的饱和溶液
C.t1℃时,向50g水中加入10g甲恰好溶解,则t℃时丙的溶解度为20g
D.将t2℃时,甲物质和乙物质的饱和溶液,分别降温至t1℃时,甲析出的水平比乙多
14.(2分)除去下列物质中的少量杂质所使用的试剂及操作办法都正确的是()
选项 | 物质(杂质) | 试剂 | 操作办法 |
A | 氧气(二氧化碳) | 氢氧化钠溶液 | 将混合气体通过足量的氢氧化钠溶液的洗气瓶 |
B | 碳酸钙(氯化钙) | 水 | 溶解、过滤、蒸发结晶 |
C | 氯化钠(碳酸钠) | 足量稀盐酸 | 蒸发结晶 |
D | 铜(铁) | 足量硫酸铜溶液 | 过滤 |
A.A B.B C.C D.D
15.(2分)为测定部分变质的氢氧化钠样品中变质的氢氧化钠的水平,某同学取该样品l3.3g于烧杯中,用滴管向其中慢慢滴加水平分数为7.3%的稀盐酸,当滴加稀盐酸lO0g,溶液中开始产生气泡,继续向其中滴加稀盐酸509,恰好不再产生气泡,由此可知该样品中变质的氢氧化钠的水平是()
A.0.4g B.0.8g C.8g D.4g
2、非选择题(共8小题,满分40分)
16.(5分)请用化学知认回答下列问题:
(1)炒菜时常常加些食醋,食醋中含有些酸是__________(填化学式)
(2)给树木刷含有硫磺粉的石灰浆的目的是__________;
(3)氢氧化钠固体需要密封保存是什么原因__________;
(4)洗涤剂可以去除油污是由于洗涤剂具备__________功能;
(5)医用酒精中乙醇的体积分数为75%,就是指__________。
17.(6分)伴随智能手机的普及,太阳能手摇两用充电器渐渐走进了千家万户,这种充电器内装蓄电装置,既能够在有太阳的时候用太阳能给电池充电,也可以在阴天手摇直接给电池充电。
(1)在不给手机充电时,手摇给充电器电池充电时的能量转化为__________,手摇充电器的主体,可以是塑料,但其手摇主轴承的材料却最好应该是__________(填字母)
A.青铜
B.生铁
C.陶瓷
(2)著名创造家爱迪生也创造过一种电池叫爱迪生电池,爱迪生电池的反应物是铁和二氧化镍(NiO2)和一种氧化物,在放电的条件下生成了阳离子和阴离子个数比均为1:2的两种碱,其反应的化学方程式为__________,反应前后铁元素的化合价变化为__________。
(3)淘汰的手机电池不可以随便遗弃,由于其中可能含有__________等有毒元素(写两种即可),所以需要收购,收购废旧电池的意义有__________(填两点)。

18.(3分)如图是盐酸滴入氢氧化钠溶液时粒子之间反应的示意图,请从微观角度回答下列问题。

(1)请将此图补充完整;
(2)在此变化中发生改变的是__________(填粒子符号),
(3)此反应的化学方程式为__________。
19.(4分)分类是学化学常见的办法。
(1)物质的作用主如果由它们的性质决定的,下面是一些物质的作用:①用作建筑材料②用于制取肥皂③用作某些气体的干燥剂④用来配制波尔多液⑤溶液用于实验室检验二氧化碳⑥用来洗涤石油商品中的残余硫酸,请依据某种物质所对应的作用的角度将它们平均分成两类。选出的一组是__________,理由是:__________。
(2)化学反应中有的反应无明显现象,需要设计实验证明化学反应是不是发生。请从反应物或生成物变化的角度,将下列实验中的A与__________(填“B”或“C”)归为一类,理由是:__________。
|
|
|
A | B | C |
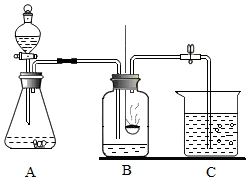
20.(7分)学习了氧气的化学性质后,小华同学对硫在氧气中燃烧的实验现象看得意犹未尽,但因为产物二氧化硫是空气污染物,只能取用少量硫粉,针对这问题,小华同学亲自动手设计了如下改进实验
(1)改用在二氧化锰催化用途下分解过氧化氢溶液制取氧气,写出反应的化学方程式__________,将长颈漏斗换成分液漏斗,控制过氧化氢溶液的滴加速率,使氧气流平稳进入集气瓶内。
(2)在教程硫燃烧的装置的基础上进行改进,将集气瓶上的玻璃片换成双孔胶塞,伴随氧气的通入,火焰从
__________色变成__________色,这说明氧气是__________的气体,因为空气中氧气含量相对较少,因此物质在空气中燃烧不如在氧气中剧烈。
(3)伴随产生气体及燃烧放热,A、B装置中压强__________,气体进入C烧杯,被C中烧碱溶液吸收,
以最大程度的降低对空气的污染,写出C中发生反应的化学方程式__________。
(4)请将实验装置图补充完整

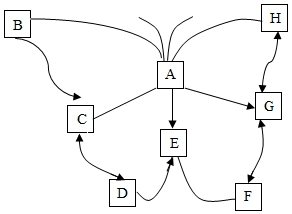
21.(4分)A~H为初中化学容易见到的八种物质,A、B、C、D、E和A、E、F、G、H分别为五种不相同种类别的物质,B、C、D、E中含有相同元素,E为蓝色溶液,H为气体,F为波尔多液成分之一,其中“﹣”表示反应,“→”表示转化。部分反应物和生成物及反应条件已略去。请回答下列问题:
(1)写出F、G物质的化学式。
F__________;G__________;
(2)B与足量A反应的实验现象__________;
(3)C转化为D的化学方程式__________;
(4)依据所学常识在图中用“﹣”或“→”补出物质之间的反应或转化关系。
22.(6分)在学化学反应中的能量变化一课时,小萍老师用食品干燥剂(主要成分为氧化钙)为自己班的同学们做了高端大气上档次的煮鸡蛋,品尝了新式煮鸡蛋后,同学们发现加入烧杯的水完全消失了,同时烧杯内的固体增多了,大伙对这个发现惊奇不已,决定对烧杯内的固体成分进行探究。
提出问题:固体的成分是什么?
猜想与假设:小姜同学猜想:氧化钙、氢氧化钙。
小王同学猜想:氢氧化钙、碳酸钙。
小高同学猜想:氧化钙、碳酸钙。
小赵同学的猜想:__________
进行实验:为了证明我们的猜想,同学们进行以下实验。取少量样品于烧杯中加入适当的水搅拌,用温度计测温度,发现温度升高,则固体中肯定含有__________,将烧杯内物质过滤,向滤渣中加入足量稀盐酸,察看到
__________现象,则该样品中肯定含有碳酸钙。冋滤液中滴加无色酚酞溶液,溶液变成红色。
讲解与结论:大伙觉得小赵同学的猜想是正确的
表达与交流:小高同学不认可。觉得我们的猜想也是正确的,他的原因是__________。经过大伙的讨论,一致觉得小高同学的猜想是不对的,理由是__________。
深思与评价:通过上述实验可以得出,判断物质成分时,依据实验现象判断只不过一方面,还可以从__________角度考虑。
23.(5分)同学们用氢氧化钠溶液和氢氧化钡溶液和无色酚酞溶液进行碱与指示剂用途的分组实验,实验结束后所有废液都倒入到同一废液缸中,为了使废液达成无害化排放,同学们向其中加入适当稀硫酸至溶液恰好变为无色,共用去水平分数为19.6%的稀硫酸200g,同学们将混合物过滤,得到白色沉淀23.3g,向滤液中加入23.3g水,得到600g7.1%的只含一种溶质的溶液,依据以上信息回答下列问题
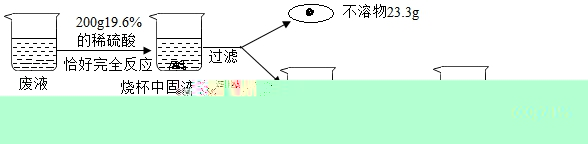
(1)写出产生白色沉淀的化学方程式__________;
(2)求解混合物中氢氧化钠的水平(x)的比率式__________;
(3)请用具体数据写明滴加稀硫酸的整个过程中,烧杯中各溶质的水平变化为__________;
(4)若实验中所用氢氧化钡溶液的浓度为17.1%,则氢氧化钠溶液的浓度为__________(酚酞溶液的体积忽视不计);
(5)若用水平分数为98%的浓硫酸配制上述实验所用的稀硫酸,需加水的水平为__________。
上海虹桥中学初三(上)期中化学试题
参考答案与考试试题分析
1、选择题(共15小题,每小题2分,满分30分)
1.【解答】解:A、纯金属和合金是金属材料,故A正确;
B、铝和空气中的氧气反应会生成致密的氧化铝薄膜,所以煤炭专用运输车车体材料为铝合金,表面刷漆是为了防锈、美观,故B正确;
C、生铁脆,不可以用生铁作为轨道的材料,故C错误;
D、碳和氧气在点燃的条件下生成二氧化碳,放出热量,所以煤炭燃烧过程中的能量转化是化学能转化成内能,故D正确。
故选:C。
2.【解答】解:
A、铁钉生锈条件探究过程中有新物质生成,是化学变化。正确;
B、氢氧化钠溶液导电过程中没新物质生成,是物理变化。错误;
C、探究分子运动过程中没新物质生成,是物理变化。错误;
D、燃烧条件探究过程中没新物质生成,是物理变化。错误。
故选:A。
3.【解答】解:A、浓硫酸的稀释办法:将浓硫酸慢慢倒入水中,并用玻璃棒搅拌,故A错;
B、向氢氧化钠中滴加盐酸是正确的,故B正确;
C、pH试纸不可以浸入溶液中,故C错;
D、氢氧化钠具备腐蚀性,要放在玻璃器皿中称量,故D错。
故选:B。
4.【解答】解:A、①中原子的最外层电子数为2,但其核外只有一个电子层,是稀少气体元素的原子,化学性质稳定;②的最外层电子数为2,在化学反应中易失去2个电子而形成阳离子;尽管最外层电子数相同,但它们化学性质不相似,故选项说法错误。
B、③原子核外有3个电子层,在元素周期表中坐落于第3周期,④⑥原子核外有2个电子层,在元素周期表中坐落于第2周期;故选项说法错误。
C、①原子的最外层电子数为2,但其核外只有一个电子层,是稀少气体元素的原子,化学性质稳定;③④的最外层为电子数均为8,均是相对稳定结构,故选项说法正确。
D、③是钠离子,⑤是硫原子,不可以形成A2B型化合物,故选项说法错误。
故选:C。
5.【解答】解:A、熟石灰具备碱性,可以用于改良酸性土壤,生石灰溶于水放热会导致作物的损害,错误;
B、铅蓄电池中含有些酸是稀硫酸,错误;
C、浓硫酸具备吸水性,但稀硫酸不具备吸水性,不可用作干燥剂,错误;
D、农业上可用氯化钠溶液来选种,故正确;
故选:D。
6.【解答】解:A、氢氧化钠固体可以吸收水蒸气,放置于空气中时,表面潮湿并渐渐溶解,该选项说法正确;
B、稀盐酸显酸性,能使石蕊试液变红色,该选项说法正确;
C、铁钉放入足量的稀盐酸中时,银白色固体表面产生气泡,银白色固体降低直至消失,该选项说法不正确;
D、氢氧化镁不溶于水,向氢氧化镁中滴加无色酚酞溶液时,溶液不变色,该选项说法不正确。
故选:CD。
7.【解答】解:A、工业用一氧化碳还原氧化铁的化学方程式为:Fe2O3+3CO![]() 2Fe+3CO2,是还原反应,但不是基本反应种类,该选项说法不正确;
2Fe+3CO2,是还原反应,但不是基本反应种类,该选项说法不正确;
B、用pH试纸测得正常雨水的pH应该是整数,该选项说法不正确;
C、用氢氧化镁治疗胃酸过多时,氢氧化镁和盐酸反应生成氯化镁和水,反应的化学方程式为:Mg(OH)2+2HCl═MgC12+2H2O,是中和反应,但中和反应不是基本反应种类,该选项说法不正确;
D、不可以用铁桶盛装波尔多液,是由于铁能和硫酸铜反应生成硫酸亚铁和铜,反应的化学方程式为:Fe+CuSO4═Cu+FeSO4,是置换反应,该选项说法正确。
故选:D。
8.【解答】解:A、为预防自行车链条生锈,用黄油涂在自行车链条上,故错误;
B、酸碱指示剂在酸性、中性、碱性溶液中需要显示不一样的颜色,牵牛花可以显示不一样的颜色,其他的花未必也可以显示不一样的颜色,故B错误;
C、氢氧化钠不慎沾到皮肤上,可用很多水冲洗后涂硼酸溶液,故C错误;
D、人体血浆的pH正常范围是7.35~7.45,故D正确。
故选:D。
9.【解答】解:由蚁酸的分子结构可知,其化学式为H2CO2。
A.蚁酸中碳、氢、氧原子的水平比等于相对原子水平之比,即1:
12:
16,故错误;
B.蚁酸中碳、氢、氧三种元素的水平比为(12×1):(1×2):(16×2)=6:
1:
16,可见蚁酸分子中氧元素水平分数最大,故正确;
C.蚁酸是由蚁酸分子构成的化合物,故错误;
D.蚁酸显酸性,能使紫色的石蕊试液变红色,故错误。
故选:B。
10.【解答】解:A、硫酸是要紧的化工材料,用于生产化肥、农药、火药等,故A错误;
B、大家正在借助和开发的其他能源有太阳能、风能、地热能等,水能不是新能源,故B错误;
C、将煤隔绝空气加大热能生成新物质﹣﹣焦炭、煤焦油、焦炉气等,故C错误;
D、地球上的咸水约占全球水储量的97.47%,故D正确。
故选:D。
11.【解答】解:A、氯化钠是由钠离子和氯离子构成的,没有氯化钠分子,故A错误;
B、夏季氦气球在阳光下曝晒过久易爆炸,是因为氦原子间的间隔随温度的升高而增大,故B正确;
C、一氧化碳有可燃性而二氧化碳不可燃,是由于一氧化碳、二氧化碳的分子构成不同,决定了物质的性质不同,故C错误;
D、氢氧化钾溶液能使紫色石蕊溶液变蓝,是由于氢氧化钾在水中会解离出了氢氧根离子,故D错误。
故选:B。
12.【解答】解:A、氢氧化钠固体溶于水会放出很多的热,而氯化钠溶于水无能量变化,用加水溶解的办法可以区别;氢氧化钠是具备腐蚀性的药品,不可以用品尝的办法区别,故A错误;
B、碳酸氢铵有刺激性气味,而硝酸铵无味,闻气味可以区别;加入稀盐酸,硝酸铵与盐酸不反应,而碳酸氢铵能与盐酸反应生成二氧化碳气体,有气泡产生,现象不同,可以区别,故B正确;
C、聚乙烯塑料是热塑性塑料,受热能重新成型,而脲醛塑料是热固性塑料,受热不可以重新成型,加热可以区别;察看颜色都是白色半透明的,没办法辨别,故C错误;
D、加入盐酸,铁能与盐酸反应产生气泡,而铜不与盐酸反应,现象不同,可以区别;在金属活动性顺序中,铜和铁都在银的前面,都能与硝酸银溶液发生置换反应,在金属表面都有固体析出,现象相同,不可以区别,故D错误;
故选:B。
13.【解答】解:A、t1℃时,甲、乙、丙三种物质溶液的状况不可以确定,所以溶液的溶质的水平分数大小也不可以确定,故A错误;
B、甲、乙物质的溶解度不可以确定,所以将100g甲的饱和溶液和100g乙的饱和溶液混合不能得到200g甲、乙的饱和溶液,故B错误;
C、t1℃时,向50g水中加入10g甲恰好溶解,则t℃时丙的溶解度为20g,故C正确;
D、将t2℃时,甲物质和乙物质的饱和溶液,分别降温至t1℃时,饱和溶液的水平不可以确定,所以析出晶体的水平也不可以确定,故D错误。
故选:C。
14.【解答】解:A、CO2能与氢氧化钠溶液反应生成碳酸钠和水,氧气不与氢氧化钠溶液反应,应再进行干燥,故选项所采取的办法错误。
B、氯化钙易溶于水,碳酸钙难溶于水,可采取加水溶解、过滤、洗涤、干燥的办法进行离别除杂,故选项所采取的办法错误。
C、碳酸钠能与过量稀盐酸反应生成氯化钠、水和二氧化碳,盐酸具备挥发性,再蒸发除去盐酸,能除去杂质且没引入新的杂质,符合除杂原则,故选项所采取的办法正确。
D、铁能与足量硫酸铜溶液反应生成硫酸亚铁溶液和铜,再进行过滤、洗涤、干燥,故选项所采取的办法错误。
故选:C。
15.【解答】解:整个过程中发生反应的化学方程式为:2NaOH+CO2=Na2CO3+H2O,Na2CO3+2HCl=2NaCl+H2O+CO2↑
由以上过程可知:2NaOH~Na2CO3~2HCl,即NaOH~HCl
设变质的氢氧化钠的水平为x
NaOH~HCl
40 36.5
x 50g×7.3%
![]()
x=4g
故选:D。
2、非选择题(共8小题,满分40分)
16.【解答】解:(1)食醋的主要成分中含有醋酸,化学式为:CH3COOH;
(2)含有硫磺粉的石灰浆具备杀菌有哪些用途,保护树木,预防冻伤,预防害虫生卵;
(3)氢氧化钠和二氧化碳反应生成碳酸钠和水,所以氢氧化钠应该密封保存;
(4)洗涤剂具备乳化功能,所以洗涤剂可以去除油污是由于洗涤剂具备乳化功能;
(5)医用酒精中乙醇的体积分数为75%,就是指:每100体积的医用酒精中含75体积的乙醇。
故答案为:(1)CH3COOH;
(2)保护树木,预防冻伤,预防害虫生卵;
(3)氢氧化钠会与空气中的二氧化碳反应生成碳酸钠而变质;
(4)乳化;
(5)每100体积的医用酒精中含75体积的乙醇。
17.【解答】解:(1)手摇给充电器电池充电时的能量转化为机械能转化成电能,与青铜硬度大,所以手摇主轴承的材料却最好应该是青铜,故选:A;
(2)铁和二氧化镍(NiO2)和一种氧化物,在放电的条件下生成了阳离子和阴离子个数比均为1:2的两种碱,所以两种碱是氢氧化亚铁和氢氧化亚镍,依据元素守恒可知,氧化物是水,化学方程式为:Fe+NiO2+H2O![]() Fe(OH)2+Ni(OH)2,反应前后铁元素的化合价变化为0→+2;
Fe(OH)2+Ni(OH)2,反应前后铁元素的化合价变化为0→+2;
(3)淘汰的手机电池不可以随便遗弃,由于其中可能含有汞、铅等有毒元素,所以需要收购,收购废旧电池的意义有:节省资源、保护环境。
故答案为:(1)机械能转化成电能,A;
(2)Fe+NiO2+H2O![]() Fe(OH)2+Ni(OH)2,0→+2;
Fe(OH)2+Ni(OH)2,0→+2;
(3)汞、铅,节省资源、保护环境。
18.【解答】解:(1)由水平守恒定律可知,在右图中应补充一个钠离子和一个水分子,如下图:
(2)由图示可知:在此变化中发生改变的是H+、OH﹣,没发生改变的是Na+、Cl﹣。
(3)由图示可知,稀盐酸与氢氧化钠反应生成了氯化钠和水,此反应的化学方程式为:NaOH+HCl=NaCl+H2O。
故答案为:(1)见上图:(2)H+、OH﹣;(3)NaOH+HCl=NaCl+H2O。
19.【解答】解:(1)用于制取肥皂、用作某些气体的干燥剂、用来洗涤石油商品中的残余硫酸,是氢氧化钠的作用;配制农药波尔多液、用作建筑材料、溶液用于实验室检验二氧化碳,是氢氧化钙的作用。
(2)二氧化碳和水反应生成碳酸,碳酸能使石蕊试液变红色,二氧化碳与氢氧化钠反应生成碳酸钠和水,碳酸钠与稀盐酸反应生成氯化钠、水和二氧化碳,也就是说与稀盐酸生成二氧化碳气体的是生成物碳酸钠,二者都是生成物是什么原因。
故答案为:
(1)②③⑥;是氢氧化钠的作用;
(2)C;AC产生的现象均是生成物致使的。
20.【解答】解:(1)过氧化氢在二氧化锰的催化用途下分解生成水和氧气,化学方程式为:2H2O2![]() 2H2O+O2↑;
2H2O+O2↑;
(2)硫在空气中燃烧产生淡蓝色火焰,在氧气中燃烧产生蓝紫色火焰,所以将集气瓶上的玻璃片换成双孔胶塞,伴随氧气的通入,火焰从淡蓝色变成蓝紫色,这说明氧气是助燃性的气体;
(3)伴随产生气体及燃烧放热,A、B装置中压强增大,氢氧化钠和二氧化硫反应生成亚硫酸钠和水,化学方程式为:2NaOH+SO2=Na2SO3+H2O;
(4)过氧化氢分解需要二氧化锰作催化剂,燃烧匙中的硫会燃烧,C中会出现气泡,所以
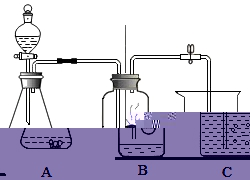
故答案为:(1)2H2O2![]() 2H2O+O2↑;
2H2O+O2↑;
(2)淡蓝,蓝紫,助燃;
(3)增大,2NaOH+SO2=Na2SO3+H2O;
(4) 。
。
21.【解答】解:(1)A~H为初中化学容易见到的八种物质,A、B、C、D、E和A、E、F、G、H分别为五种不相同种类别的物质,B、C、D、E中含有相同元素,E为蓝色溶液,H为气体,F为波尔多液成分之一,F会与E发生反应,所以F是氢氧化钙,E是氯化铜,G和氢氧化钙可以相互转化,所以G是水,D会转化成氯化铜,所以D是铜,C可以是氧化铜,B会转化成氧化铜,所以B是氢氧化铜,A是盐酸,H是氢气,经过验证,推导正确,所以F是Ca(OH)2,G是H2O;
(2)B与足量A反应的实验现象是:蓝色固体渐渐溶解,溶液变成蓝色;
(3)C转化为D的反应是铜和氧气在加热的条件下生成氧化铜,化学方程式为:2Cu+O2![]() 2CuO;
2CuO;
(4)通过剖析可知,氢气会与氧化铜反应,盐酸会与氢氧化钙反应,所以

故答案为:(1)Ca(OH)2,H2O;
(2)蓝色固体渐渐溶解,溶液变成蓝色;
(3)2Cu+O2![]() 2CuO;
2CuO;
(4)

22.【解答】解:猜想与假设:氧化钙与水反应生成氢氧化钙,氢氧化钙与二氧化碳反应生成碳酸钙和水,由此还可以提出以下猜想:固体的成分包含氧化钙、氢氧化钙、碳酸钙;故填:氧化钙、氢氧化钙、碳酸钙;
进行实验:氧化钙与水反应生成氢氧化钙,此反应放出热量,若取少量样品于烧杯中加入适当的水搅拌,用温度计测温度,发现温度升高,则固体中肯定含有氧化钙;碳酸钙与稀盐酸反应生成氯化钙、水和二氧化碳,若向滤渣中加入足量稀盐酸,察看到产生气泡,则该样品中肯定含有碳酸钙;故填:氧化钙;产生气泡;
表达与交流:假如固体中不含氢氧化钙,氧化钙也能与水反应生成氢氧化钙,氢氧化钙微溶于水,形成的溶液显碱性,也能使无色的酚酞试液变红色,所以小高同学不认可,觉得我们的猜想也是正确的;故填:假如固体中不含氢氧化钙,氧化钙也能与水反应生成氢氧化钙,氢氧化钙微溶于水,形成的溶液显碱性,也能使无色的酚酞试液变红色;
加入烧杯内的水全部消失,说明水参加了反应,化学反应前后元素的类型不变,生成物中肯定含有氢元素,小高猜想的物质中均不含氢元素,所以错误;故填:加入烧杯内的水全部消失,说明水参加了反应,化学反应前后元素的类型不变,生成物中肯定含有氢元素,小高猜想的物质中均不含氢元素,所以错误;
深思与评价:通过上述实验可以得出,判断物质成分时,依据实验现象判断只不过一方面,还可以从化学反应前后元素的类型不变考虑。故填:化学反应前后元素的类型不变。
23.【解答】解:(1)氢氧化钠与硫酸反应生成硫酸钠和水;氢氧化钡与硫酸反应生成硫酸钡白色沉淀和水;故填:Ba(OH)2+H2SO4=BaSO4↓+2H2O;
(2)设生成23.3g硫酸钡沉淀需要硫酸的水平为m,需要氢氧化钡的水平为n,则:
Ba(OH)2+H2SO4=BaSO4↓+2H2O
171 98 233
n m 23.3g
![]()
m=9.8g
![]()
n=17.1g
则与氢氧化钠反应的硫酸的水平为:200g×19.6%﹣9.8g=29.4g
设与29.4g硫酸反应所需要氢氧化钠的水平为x,生成硫酸钠的水平为y,则:
2NaOH+H2SO4=Na2SO4+2H2O
80 98 142
x 29.4g y
![]()
x=24g
![]()
y=42.6g
故填:![]() ;
;
(3)依据计算数据可知,滴加稀硫酸的整个过程中,烧杯中氢氧化钡的水平由17.1g变成0g,氢氧化钠的水平由24g变成0g;硫酸钠的水平由0g变成42.6g;故填:氢氧化钡的水平由17.1g变成0g,氢氧化钠的水平由24g变成0g;硫酸钠的水平由0g变成42.6g;
(4)设废液的水平为w,由水平守恒定律可知:w+200g=600g,
w=400g
则氢氧化钠溶液的浓度为![]() ×100%=6%;故填:6%;
×100%=6%;故填:6%;
(5)设需要加水的水平为s,则:
200g×19.6%=(200g﹣s)×98%
s=160g
故填:
160g。