上宝中学第一学期初中三年级化学9月考试题
相对原子水平:H-1 O-18 C-12 P-31 Fe-56
1、选择题
1. 2015 年 10 月,因发现抗疟疾药青蒿素而获诺贝尔自然科学类的中国当地科学家是( )




A.莫言 B.杨振宁 C.屠呦呦 D.林巧稚
2. 物质的变化是多种多样的,其中是化学变化的是( )
A. 抹在墙上的石灰浆渐渐变硬 B. 用活性炭消除冰箱中的异味
C. 用玻璃刀切割玻璃 D. 由空气制氧气
3. 氧元素由化合态转化为游离态的变化是( )
![]() A. 2C H + 5O ¾点¾燃¾® 2H O+4CO
A. 2C H + 5O ¾点¾燃¾® 2H O+4CO
B. H CO ¾D¾® H O+CO
![]()
![]() C. 4P+5O ¾点¾燃¾® 2P O
C. 4P+5O ¾点¾燃¾® 2P O
D. 2H O ¾通¾电¾® 2H +O
![]() 4. 以下化学符号里的“3”,表示分子个数的是( )
4. 以下化学符号里的“3”,表示分子个数的是( )
A. 3H B. NH3 C. 3H2 D. O3
5. 下列实验操作中正确的是( )

6. 下列说法正确的是( )
A. 4mol H2 中含 8mol 氢 B. 1mol 磷酸 的水平为 98 克/摩尔
C. 0.5mol H2O2 中含有 1mol O2 D. 等水平的 O2 和 O3 中所含氧原子的物质的量相同
7. 在空气中易变质,且变质过程与氧气没关系的物质是( )
A. 铁 B. 生石灰 C. 白磷 D. 木炭
8. 下列对实验现象的描述,正确的是( )
A. 铁丝在空气中剧烈燃烧,火星四射,生成黑色固体
B. 向滴有酚酞试液的氢氧化钠溶液中滴加过量的盐酸,试液由红色变为无色
C. 硫在氧气中燃烧产生微弱的淡蓝色火焰,并生成刺激性气味的气体
D. 红磷在氧气中燃烧产生很多浓厚的白色烟雾
9. 溶解适当的固体碘制成消毒液,应该用( )
A. 蒸馏水 B. 酒精 C. 汽油 D. 生理盐水
10. 四种植物花汁在不同溶液这呈现的颜色如下表。若要检验某溶液的酸碱性,最好使用( )
pH |
<7 |
=7 |
>7 |
玫瑰花汁 | 粉红 | 粉红 | 绿 |
万寿菊花汁 | 黄 | 黄 | 黄 |
大红花汁 | 橙 | 粉红 | 绿 |
万年青花汁 | 橙黄 | 浅绿 | 浅绿 |
A. 玫瑰花汁 B. 万寿菊花汁 C. 大红花汁 D. 万年青花汁
11. 下列各组物质加入水中,充分混合后,能得到溶液的是( )
A. 氧化铁 B. 汽油 C. 硫酸铜 D. 花生油
12. 影响固体物质在溶剂中溶解度大小的原因是( )
①溶质的性质 ②温度 ③压强 ④溶质的水平 ⑤溶剂的水平 ⑥溶剂的性质
A. ①②⑥ B. ①③⑤ C. ①④⑤ D. ②④⑥
13. 给下列溶液蒸发时,溶液溶质的水平分数可能减少的是( )
A. 食盐溶液 B. 盐酸 C.稀硫酸 D.硝酸钾溶液
14. 某溶液 200g,蒸发 20g 水后,析出 8g 晶体;又蒸发 20g 水后析出晶体 12g,则该温度下,某物质的溶 解度是( )
A. 40g/100g 水 B. 50g/100g 水 C. 60g/100g 水 D. 100g/100g 水
15. 要使氢氧化钙不饱和溶液转化为饱和溶液,可采取的办法为( )
①升温 ②降温 ③加水 ④加生石灰 ⑤加熟石灰 ⑥蒸发溶剂
A. ②⑤⑥ B. ①④⑤⑥ C. ①⑤⑥ D. ②④⑤⑥
16. 下列有关溶液的认识中,不正确的是( )
A. 析出晶体后的溶液是该温度下的饱和溶液
B. 溶液中的化学反应一般较快
C. 同种溶质的饱和溶液肯定比它的不饱和溶液浓度大
D. 食物里的营养价值经消化变成溶液,易让人体吸收
17. 实验室用氯化钠配制 50.0g 溶质的水平分数为 10%的氯化钠溶液,下列说法错误的是( )
A. 用天平称取 5.0g 氯化钠
B. 用量程为 10ml 的量筒量取所需的水
C. 溶解氯化钠时,用的玻璃仪器有烧杯、玻璃棒
D. 将配制好的溶液装入细口瓶中,塞好瓶塞并贴上标签
18. 浓度为 10%的氢氧化钠溶液 100g,假如浓度要增加一倍,应使用( )
A. 将溶液蒸发掉一半 B. 加入 100g10%的氢氧化钠溶液
C. 增加 10g 氢氧化钠固体 D. 溶剂蒸发掉 45g
19. 现有 20℃时 200g 硝酸钾饱和溶液,以下操作中,溶质与溶剂的水平比发生变化( )
A. 温度不变蒸发掉 20g 水 B. 温度不变加入 10g 硝酸钾
C. 温度不变加入 20g 水 D. 升温到 40℃
20. 将 wg KNO3 的不饱和溶液恒温蒸发水分,直到有晶体析出。则正确表示析出晶体水平(m)与蒸发时 间(t)的变化关系图象是( )

21. 向 95g10%的 NaCl 溶液中加入 5g CuSO4 并搅拌至完全溶解,则所得 NaCl 的溶质水平分数是( )
A. 15.3% B. 14.5% C. 10% D. 9.5%
22. 有一固体物质(不含结晶水)的溶液甲,在肯定温度下,历程如下变化:
溶液甲 ¾¾蒸发¾10g水¾® 溶液乙 ¾¾蒸发¾10g¾水 ¾® 溶液丙
无晶体析出
析出3克晶体
据此判断下列结论中正确的是( )
A. 该温度下,固体物质的溶解度是 30g/100g 水
B. 溶液丙再蒸发 10g 水,析出晶体的水平肯定大于 3g
C. 溶液乙肯定是不饱和溶液
D. 溶液乙和溶液丙的溶质水平分数可能相等
 23. 如图为 A 物质的溶解度曲线,M、N 两点分别表示 A 物质的两种溶液。下列做法不可以达成 M、N 间的 相互转化的是(A 从溶液中析出时不带结晶水)( )
23. 如图为 A 物质的溶解度曲线,M、N 两点分别表示 A 物质的两种溶液。下列做法不可以达成 M、N 间的 相互转化的是(A 从溶液中析出时不带结晶水)( )
A. 从 M→N:先将 M 降温再过滤,再将它升温
B. 从 M→N:先将 M 升温再将它蒸发掉部分水 C. 从 N→M:先向 N 中加入适当固体 A 再降温 D. 从 N→M:先将 N 降温再加入适当固体 A
24. 向 20℃饱和石灰水中加入适当的氧化钙粉末,充分反应,下列说法错误的是( )
A. 溶液未冷却到 20℃时肯定是饱和溶液
B. 温度未冷却到 20℃时,溶质的水平分数肯定比原溶液大
C. 溶液冷却到 20℃时,溶液水平比原溶液变小
D. 溶液冷却到 20℃时,溶质的水平分数与原溶液相等
25. t℃时,向 10g 水中渐渐加入硝酸钾晶体至饱和,则此过程中该溶液满足下图 a、b 两个变量的变化关系 的是( )
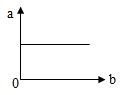 A. a—溶解度,b—溶质水平
A. a—溶解度,b—溶质水平
B. a—溶质的水平分数,b—溶质水平
C. a—溶质水平,b—溶剂水平
D. a—溶解度,b—溶剂水平
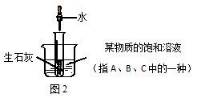
26. 为确定某一原因对物质溶解性的影响,A、B、C、D 四个实验中能与实验Ⅰ作为一组达到实验目的的 是( )
实验编号 | 温度 | 溶剂类型 | 溶剂体积 | 加入固体水平 | 溶解状况 |
实验 I | 20℃ | 水 |
10mL | 5g 硝酸钾 | 部分溶解 |
A | 20℃ | 酒精 |
10mL | 50g 硝酸钾 | 几乎不溶解 |
B | 20℃ | 水 |
10mL | 5g 食盐 | 部分溶解 |
C | 80℃ | 水 |
20mL | 5g 硝酸钾 | 全部溶解 |
D | 80℃ | 水 |
10mL | 10g 硝酸钾 | 全部溶解 |
 2、填空题
2、填空题
27. 水是生活生产中不可或缺的物质。
①平时生活和生产中容易见到的水,是纯净物的是____________________。
A. 矿泉水 B. 蒸馏水 C. 河水 D. 雨水
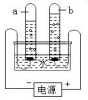 ②右图所示的浅易净化水的装置,运用了如下净水办法中的____________________(填序号)。
②右图所示的浅易净化水的装置,运用了如下净水办法中的____________________(填序号)。
A. 消毒 B. 过滤 C. 蒸馏 D. 吸附
③维持水的化学性质的微粒是____________________(填名字),图乙中电解水的化学方程式是
____________________,b 试管中产生的气体是____________________,检验该气体的办法是
![]()
![]() ,实验说明水是由
,实验说明水是由
组成的。
④水中滴入几滴石蕊试液,向其中通入二氧化碳气体,可看到石蕊试液变
色,其反应原理是
![]()
![]() (用化学方程式表示),该原理也可用于制碳酸饮料。打开可乐瓶有很多气泡逸出,
(用化学方程式表示),该原理也可用于制碳酸饮料。打开可乐瓶有很多气泡逸出,
![]()
![]() 说明压强减小,气体溶解度变
说明压强减小,气体溶解度变
(填“大”或“小”),当气泡逸出后,瓶内的液体
(填“是”或“不是”)
二氧化碳的饱和溶液。
⑤20℃,食盐的溶解度是 36g/100g 水,此时饱和溶液的溶质的水平分数是 26.5%。则“100g”表示____________________;
“%”表示____________________。
A. 溶质水平 B. 溶剂水平 C. 溶液水平 D. 溶液体积
⑥将 15g 下列物质投入 85g 水中,使之充分溶解,试比较所得溶液的溶质水平分数的大小。
a. 二氧化硫 b. 氯化钠 c. 硫酸铜晶体 d. 氧化钙
28. 某品牌补铁剂主要成分是富马酸亚铁 ,富马酸亚铁有____________________种元素组成,其摩尔水平是
![]() ____________________,该分子中各原子的个数比为____________________,____________________mol 的 C4 H2 FeO4 中约含有 6.02 ´10 个
____________________,该分子中各原子的个数比为____________________,____________________mol 的 C4 H2 FeO4 中约含有 6.02 ´10 个
氢原子。一个 C4 H2 FeO4 分子的水平(单位:克)的计算表达式是____________________(列式即可)。
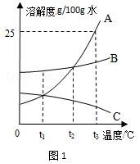 29. A、B、C 三种固体物质在水中的溶解度曲线如图 1 所示,请回答:
29. A、B、C 三种固体物质在水中的溶解度曲线如图 1 所示,请回答:
①____________________℃时,A、B 两种物质溶解度相等;
② t3 ℃时恰好溶解掉等水平的 A、B、C 三种物质,所消耗的水最多的是
____________________;
③若将 t3 ℃三种物质的饱和溶液分别降温 t1 ℃时,则对三种溶液的说法正确 的是____________________;
 A. 溶剂水平:C>B>A B. 都是饱和溶液
A. 溶剂水平:C>B>A B. 都是饱和溶液
C. 溶质水平分数:B>A>C D. 析出溶质的水平:B>A>C
④图 2 所示,向盛有生石灰的试管中加入适当水,反应的化学方程式 是__________。实验时,烧杯中有固体析出,判断该饱和溶 液中析出的晶体是____________________(填 A 或 B 或 C)。
⑤常温时,某物质在不同水平的水中溶解达到饱和状况,溶质的水平与水的水平关系如图所示。
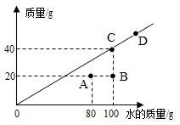 a. 常温时,该物质的溶解度是______________________________
a. 常温时,该物质的溶解度是______________________________
b. A 点时,该溶液的溶质水平分数为____________________
c. 图中 A、B、C、D 四个点表示的溶液中溶质水平分数从大到小的关
系是____________________
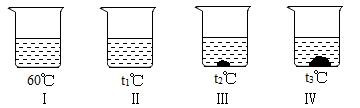 ⑥向不同温度的 100g 水中分别放入等水平的某物质,维持温度不变,溶解状况如右图所示。有关剖析
⑥向不同温度的 100g 水中分别放入等水平的某物质,维持温度不变,溶解状况如右图所示。有关剖析
正确的是( )
a. 溶液温度:Ⅰ>Ⅱ>Ⅲ>Ⅳ
b. 溶液水平:Ⅰ=Ⅱ>Ⅲ>Ⅳ
c. 溶液Ⅰ肯定是不饱和溶液
d. 使Ⅳ中的固体全部溶解,溶质水平分数可能不变
3、实验题
30. 依据题意回答:
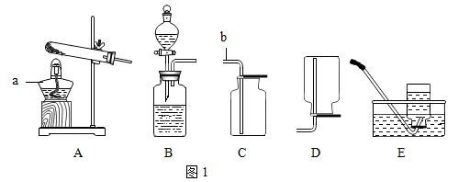
①写出仪器名字:a____________________,b____________________;
②实验室用氯酸钾和二氧化锰的混合物制取氧气,可选择的装置是____________________(填编号)写出反应的化学方程 式____________________;
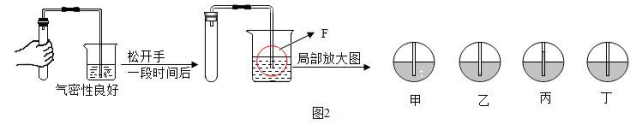 ③下图是检验装置气密性的过程。最后在 F 处察看到的现象是____________________(选填“甲~丁”);
③下图是检验装置气密性的过程。最后在 F 处察看到的现象是____________________(选填“甲~丁”);
![]() ④ 资料表明:高铁酸钾 固体也可以用于制取氧气,原理如下: 策略1、 4K FeO ¾D¾® 2Fe O + 4K O+3O
④ 资料表明:高铁酸钾 固体也可以用于制取氧气,原理如下: 策略1、 4K FeO ¾D¾® 2Fe O + 4K O+3O
策略2、 4K 2 FeO4 +10H2O ® 4Fe 3¯ +8KOH+3O2
关于以上策略说法错误的是____________________
a. 策略一是分解反应
b. 策略二更节能方便
c. 策略1、二均可在图 1 的装置 B 中进行实验
d. 制取等水平的氧气,两种策略所需高铁酸钾的水平相等
4、计算题
31. 把 40℃的氯酸钾不饱和溶液 50g 平均分成两份,一份蒸发掉 5g 水后又回到 40℃,另一份加入 0.7g 氯 酸钾,结果两者都恰好饱和。求:
(1)40℃时氯酸钾的溶解度;
(2)该温度下,氯酸钾饱和溶液的溶质水平分数.
32. 农业上常用饱和食盐水进行选种。小明家现有某浓度的氯化钠溶液 50kg,为了确定该氯化钠溶液的浓 度,小明取出 70g 该溶液进行实验,得到下列数据:
蒸发水的水平(g) |
10 |
20 |
30 |
40 |
50 |
冷却到室温时析出氯化钠的水平(g) |
0 |
0 |
0 |
2.8 |
6.4 |
求:(1)原溶液中氯化钠的水平分数
(2)在 50kg 该溶液中加入多少千克氯化钠刚好成为该室温时的饱和溶液?
33. 某兴趣小组用右图装置(碱石灰是氧化钙和固体氢氧化钠的混合物,极易吸收水蒸气,常常用作干燥 剂),测定过氧化氢溶液中溶质的水平分数,测得有关数据如下:整套装置水平为 50 克。


请回答:
(1)双氧水样品中加入二氧化锰,二氧化锰起____________________用途,反应生成氧气的物质的量为
![]() (2)计算该过氧化氢溶液中溶质的水平分数(依据化学方程式列式计算)
(2)计算该过氧化氢溶液中溶质的水平分数(依据化学方程式列式计算)
(3)实验装置中锥形瓶加接盛有碱石灰的干燥管用途是____________________。假如实验装置中不接盛有碱 石灰的干燥管,测得的过氧化氢溶液溶质的水平分数会偏大,缘由是______________________________。
参考答案
一 选择题
1-5 CADCC 6-10 DBBBC 11-15 CABCB 16-20 CBADB 21-25 DDBBA 26 B
二 填空题
27 ①B ②C
![]() ③水分子; 2H O ¾通¾电¾® 2H +O ;O2;带火星的木条伸入试管中,木条复燃则证明是氧气; 氢氧两种元素
③水分子; 2H O ¾通¾电¾® 2H +O ;O2;带火星的木条伸入试管中,木条复燃则证明是氧气; 氢氧两种元素
④红色; CO2 +H 2O ® H 2CO3 ;小;是
⑤溶剂水平;溶质水平分数
⑥a>b>c>d
170
![]() 28 4;170g/mol;4:2:1:4;0.5;
28 4;170g/mol;4:2:1:4;0.5;
6.02 ´1023
29 ①t2;②C;③C;④ CaO+H2 O ® Ca2 ;Ca2;
⑤40g/100gH2O;20%;C=D>A>B
⑥ bd
三 实验题
30 (1)酒精灯;导管
(2)A ;E; 2KClO3
¾M¾nO¾2 ® 2KCl+3O ;
![]()
![]() (3)丙
(3)丙
(4)C
计算题
31(1)
0.7
![]() 5
5
= S S=14g/100gH O;
![]()
![]() 100
100
(2)
14
![]() 100 + 14
100 + 14
´100% = 12.3%
32 (1)14.3%
(1)8.3kg
33 (1)催化用途;0.8g
![]() (2)
(2)
2H O ¾M¾nO¾2 ® 2H O+O
68 32
X 0.8
____________________ = ____________________
x 0.8
X=1.7g
84-16=68g
![]() 1.7 ´100% = 2.5%
1.7 ´100% = 2.5%
68
(3)吸收装置内产生的水蒸气;将水蒸气的水平算为氧气







