上海交通大学附属中学 2019—2020 学年度第二学期
高中一年级化学期末考试题
相对原子水平:C-12;O-16;Al-27;Cl-35.5;Ca-40;Fe-56
1、选择题(每小题 2 分,共 40 分,每小题只有一个正确选项)
1.在预防新冠中,化学消毒剂发挥了要紧用途。以下不是借助氧化性来消毒的是
A.84 消毒液 B.75%酒精 C.臭氧 D.H2O2
2.下列溶液中导电性最强的是
A.1.0L 0.1mol/L 醋酸 B.2.0L 0.2mol/L H2SO3 溶液
C.0.1L 0.2mol/L H2SO4 溶液 D.0.5L 0.1mol/L 盐酸
3.硫酸工业生产的催化氧化过程,叙述正确的是
A.是吸热反应 B.在常压下进行
C.在沸腾炉中进行 D.用铁触媒做催化剂
4.在检验某固体中是不是含有 NH4+时,肯定用不到的试剂或试纸是
A. NaOH 溶液 B. 蒸![]() 馏水
馏水
C. 蓝色石蕊试纸 D. 红色石蕊试纸
5.不是氮的固定的过程是
A.放电条件下氮气与氧气化合
B.在肯定条件下用NH3 与 CO2 合成尿素
C.豆科植物根瘤菌把空气中的氮气变成含氮化合物
D.工业合成氨
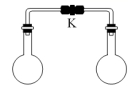 6.室温时,两个容积相同的烧瓶中分别盛有下面两种气体(同温同压),打开弹簧夹 K,使两烧瓶内的气体充分混合后,容器内的压强最小的是
6.室温时,两个容积相同的烧瓶中分别盛有下面两种气体(同温同压),打开弹簧夹 K,使两烧瓶内的气体充分混合后,容器内的压强最小的是
A.H2S 和 SO2 B.NH3 和HCl
C.H2 和 Cl2 D.NO 和 O2
7.若溶液中存在较多的H+、SO42—、NO3—,则该溶液中还可能很多存在的离子组是
A.Al3+、CH3COO—、Cl— B.Mg2+、Ba2+、Br—
C.Mg2+、Cl—、I— D.Na+、NH4+、Cl—
8.将 0.56g 铁投入 100mL 0.1mol/L 的稀硫酸中,2 min 后两者恰好完全反应,若忽视溶
液体积变化,则该反应的速率可以表示为 υ = 0.005 mol/,其中X 为
A.SO42— B.FeSO4 C.H+ D.Fe
9.检验某Na2SO3 溶液是不是变质,所使用的试剂正确的是
A.稀 H2SO4,品红溶液 B.稀 HNO3,BaCl2 溶液
C.稀盐酸,BaCl2 溶液 D.稀盐酸,Ba2 溶液
![]() 10.密闭容器中反应CO + H2O CO2 + H2 + Q(Q>0)达到平衡。其他条件不变时,不可以使正反应速率加快的手段是
10.密闭容器中反应CO + H2O CO2 + H2 + Q(Q>0)达到平衡。其他条件不变时,不可以使正反应速率加快的手段是
A.通入水蒸气 B.缩小容器体积
C.离别出 CO2 D.升高温度
11.下列反应可用离子方程式 2H+ + CO32‒ → H2O + CO2↑表示的是
A.向 Na2CO3 溶液中滴加过量醋酸 B.向硫酸中滴加少量 Na2CO3 溶液 C.向 Na2CO3 溶液中滴加少量稀盐酸 D.向 Na2CO3 溶液中通入 SO2 气体
12.向 10mL 0.01mol/L H2SO4 溶液滴加同浓度的 BaCl2 溶液至恰好完全沉淀,此时溶液的 pH 为
A.2 B.3 C.5 D.7
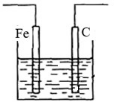 13.用如图所示装置电解饱和食盐水,正确的是
13.用如图所示装置电解饱和食盐水,正确的是
A.Fe 棒连接电源正极
B.电子由 Fe 棒到 C 棒,再回到 Fe 棒
C.C 棒上发生 2H++2e→H2↑
D.Fe 棒附近,产生NaOH
14.体积相同的盐酸和醋酸溶液,[Cl‒] = [CH3COO‒]= 0.01 mol/L,则正确的说法是
A.pH:醋酸>盐酸
B.完全反应消耗NaOH 的量:醋酸>盐酸
C.与相同的 Zn 粉末反应的起始速率:醋酸<盐酸
D.分别用水稀释相同倍数后,所得溶液中:[Cl‒] =[CH3COO‒]
15.已知 0.1mol·L-1 的二元酸 H2A 溶液的 pH=4.0,则正确的说法是A.在 Na2A、NaHA 两溶液中,阴阳离子类型不相同
B.在溶质物质的量相等的 Na2A、NaHA 两溶液中,阴离子总数相等
C.在 NaHA 溶液中肯定有:[H2A]+[H+]=[OH-]+[A2-] D.在 Na2A 溶液中肯定有:[Na+]>[A2-]> [H+]>[OH-]
16.不可以用勒沙特列原理来讲解的选项是
A.氨水应密闭保存,放置在低温处
B.用排饱和食盐水的办法采集氯气
![]() C.对H2+I2 2HI平衡体系加压,混合气体颜色加深
C.对H2+I2 2HI平衡体系加压,混合气体颜色加深
D.饱和硫酸铜溶液投入CuSO4 晶体,析出 CuSO4•5H2O
![]() 17.肯定温度下的密闭容器中发生可逆反应 C + H2O CO + H2,肯定能说明该反应已达到平衡状况的是
17.肯定温度下的密闭容器中发生可逆反应 C + H2O CO + H2,肯定能说明该反应已达到平衡状况的是
A.v 逆= v 正 B.容器中物质的总水平不发生变化
C.n:n=1:1 D.生成 1molCO 的同时生成 1molH2
18.25℃时,用蒸馏水稀释 10ml pH=11 的氨水,叙述正确的是
A.该 10ml 氨水的浓度为 0.001mol/l
B.稀释至 100ml 时,溶液的 pH 小于 10
C.稀释时,溶液中所有些离子的浓度均变小
D.稀释过程中,[NH4+]/[NH3•H2O] 值肯定增大
![]() 19.已达到平衡的反应 mA+nB pC+qD-Q ,改变下列条件,一定能使化学平衡发生移动的手段是
19.已达到平衡的反应 mA+nB pC+qD-Q ,改变下列条件,一定能使化学平衡发生移动的手段是
A.增加B 的物质的量 B.加压
C.加入催化剂 D.降温
20.同温度、同物质的量度浓度的 NaX 溶液的 pH 大于 NaY 溶液的 pH,由此判断
A.溶液中X-浓度大于 Y-
B.HX 酸性强于 HY
C.水的电离程度前者小于后者
D.前者溶液中的HX 浓度大于后者溶液的 HY 浓度
2、综合题(共 60 分)
(一)本题共 15 分
氮化铝(AlN)是原子晶体。在室温下,具备强度高、导热性好的特征,是好的耐热冲击材料。在 800~1000℃下,铝粉可与氮气直接化合生成氮化铝。
21.Al 非常活泼,但与N2 反应需要高温条件,请用结构常识说明缘由。
22.室温下,AlN 在水中缓慢反生复分解反应,生成白色沉淀。写出上述反应的化学方程式。
反应后所得溶液呈碱性,其缘由是____________________。反应后所得溶液加热到 90℃时,溶液 pH 减小,请用化学平衡原理说明理由。
23.相同浓度的铝铵钒2·12H2O)溶液与 NH4Cl 溶液,其中[NH4 ]前者
![]() ____________________后者(选填“ > ”、“ = ”或“ < ”)。
____________________后者(选填“ > ”、“ = ”或“ < ”)。
24.向适量 NH4Cl 溶液中滴加NaOH 溶液至溶液呈中性,则错误的判断是____________________
![]() a. [Na+]= [NH3·H2O] b. [NH4 ]+[Na ]>[Cl ] c. [NH4 ]+[NH3·H2O]=[Cl ]
a. [Na+]= [NH3·H2O] b. [NH4 ]+[Na ]>[Cl ] c. [NH4 ]+[NH3·H2O]=[Cl ]
25.向含 0.04mol NH4HSO4 的溶液中,逐滴加入 100mL 0.2mol·L-1Ba2,此反应的离
![]() 子方程式为 。
子方程式为 。
(二)本题共 16 分
引火铁是反应活性非常强的准纳米级的铁粉,可以通过 Fe3O4 与 H2 反应制得。肯定温度下,在 2L 体积可变的密闭容器中发生下列反应:
![]() Fe3O4 + 4H2 3Fe + 4H2O
Fe3O4 + 4H2 3Fe + 4H2O
26.该反应平衡常数的表达式为 K=____________________。
已知 1000℃时 K=4.0,1300℃时 K=3.5,则正反应为____________________。
 27.右图纵坐标表示固体水平。曲线 a 代表的反应, 在打造平衡过程中的平均速率 υ为____________________。曲线 a 与曲线 b 所代表的反应,体系压强的大小关系是____________________。
27.右图纵坐标表示固体水平。曲线 a 代表的反应, 在打造平衡过程中的平均速率 υ为____________________。曲线 a 与曲线 b 所代表的反应,体系压强的大小关系是____________________。
28.将平衡状况A 转变为 B,则需要改变的外面条件是____________________。
29.某温度下维持体积不变,向曲线 b 的平衡状况中,通入适量的 H2O重新达到平衡后,H2 和H2O的浓度之比____________________。说明理由。
30.1300℃时,测得体系中H2 和 H2O的浓度分别为 0.1mol/L、1.6mol/L,则此时
υ 正____________________υ 逆,其缘由是____________________。
(三)本题共 14 分
氯气是要紧的化工材料,而高纯氯气也是电子工业干刻、光导纤维、晶体成长和热氧化的主要用品。在工业上,生产氯气的主要渠道是电解饱和食盐水。
完成下列填空:
31.写出电解饱和食盐水的离子方程式。
32.向饱和食盐水中通入氯化氢气体时,有白色晶体出现。用化学平衡原理,说明析出白色晶体是什么原因。
33.借助右图装置电解 CuCl2 溶液,得到氯气。
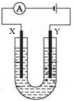 检验氯气的实验办法是______________________________。水平增加的电极是____________________(填“X”或“Y”)。
检验氯气的实验办法是______________________________。水平增加的电极是____________________(填“X”或“Y”)。
若用该装置电解氯化铵溶液,则有氨气逸出,其缘由是
____________________。
34.已知电离常数:H2CO3>HClO> HCO3-。
向 NaClO 溶液中通少量 CO2,所发生化学反应的离子方程式为____________________
____________________。
(四)本题共 15 分
硫酸铜可应用于电镀、颜料、医药、农药等方面。下图是探究铜与浓硫酸反应生成硫酸铜的实验装置图:
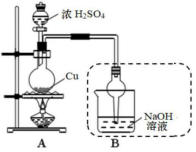 |
完成下列填空:
35.写出烧瓶中反生反应的化学方程式。
写出图中虚线框内装置有哪些用途。
____________________、____________________
36.实验结束后,烧瓶中有白色固体生成。
写出检验烧瓶中此白色固体是 CuSO4 的方便的办法。
37.实验中,若反应条件控制不当,则会有少量黑色难溶物 CuS、Cu2S 固体生成。
取此黑色固体样品 a g,隔绝空气加热,发生 2CuS ![]() Cu2S + S,充分反应后得到 b
Cu2S + S,充分反应后得到 b
g Cu2S,则 CuS 的水平分数 ω =____________________(用含 a、b 的代数式表示)。
加热温度过高,会有部分 Cu2S 分解生成Cu,则 ω____________________(选填“偏大”“偏小” 或“不变”)。







